检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
线粒体是细胞的“能量工厂”,依赖上千种蛋白质来维持呼吸链复合物组装、代谢稳态调控以及多种信号通路。值得注意的是,超过99%的蛋白质并非在线粒体内合成,而是由核基因编码,在细胞质合成,随后通过专门的转位系统运输进入线粒体。这一跨膜转位过程如何实现高选择性、高效率与精确分拣,一直是细胞生物学的核心问题之一,也与多种人类疾病密切相关,如线粒体病、神经退行性疾病(阿尔茨海默病、帕金森病)、代谢综合征与肿瘤发生等。
在所有转位通路中,由外膜TOM(translocase of the outer membrane)与内膜TIM23(translocase of the inner membrane 23)复合体构成的前序列转位途径承担了超过60%的线粒体蛋白的转位任务。该途径负责识别携带线粒体定位序列的前体蛋白,将其先转位通过外膜,再经 TIM23 复合体插入内膜或输送至基质。但长期以来,该蛋白转位通路的具体分子组成一直悬而未决,蛋白质底物如何被精准分拣至不同线粒体亚区室的分子机制很不明确。李龙实验室长期致力于解析蛋白质进入线粒体和内质网的转位分子机理。该课题组曾于2023年在Nature Structural & Molecular Biology杂志上发表了题为“Molecular pathway of mitochondrial preprotein import through the TOM-TIM23 supercomplex”的论文,利用冷冻电镜对线粒体前序列转位途径中的TOM–TIM23 超级复合体进行了初步分析,同时利用生化手段揭示了与领域内长期固有认知不同的核心转位路径。
2025 年 8 月 28 日,必赢bwin线路检测中心李龙课题组与定量生物学中心宋晨课题组合作,再次在 Nature Structural & Molecular Biology 在线发表研究论文“Dynamic TOM–TIM23 supercomplex directs mitochondrial protein translocation and sorting”,解析了TOM–TIM23 超级复合体在转运多肽底物状态下的高分辨率冷冻电镜结构,分析其动态过程,首次在分子水平揭示了内膜TIM23复合体如何根据底物疏水性控制蛋白进入基质或插入内膜,并阐明了其区别于内质网上的经典蛋白转位通道Sec的全新转位机制。

由于蛋白跨膜转位过程具有瞬时性与高度动态性,且前体蛋白与通道之间往往是弱相互作用,TIM23 复合体的高分辨率结构解析长期面临挑战。为此,研究团队设计了一种特殊前体底物,其两端分别锚定于 TOM 与 TIM23 复合体,实现了对转位过程的“瞬间冻结”,成功稳定了活性状态的超级复合体。
利用该策略,研究获得了 TOM 复合体(2.9 Å)和 TIM23 复合体(3.8 Å)在转运活性状态下的高分辨率结构。整体结构显示,尽管TOM与TIM23复合体通过多肽底物紧密串联,两复合体仍相对高度动态。多肽底物在 TOM 通道内呈现多种由极性残基稳定的动态构象,有助于其穿越外膜。处于多肽底物转运中间态的TIM23复合体结构显示,活跃状态下的TIM23复合体的核心组装由Tim17、Tim23、Mgr2和Tim44异源四聚体构成。从结构角度证实,TIM23 通道并非由 Tim23 亚基构成,而是由 Tim17–Mgr2 形成“半开放”沟槽,其膜间隙侧入口处由负电荷区块构成,中央四个疏水残基构成约 9 Å 的限制环。
该研究进一步发现Mgr2亚基可作为疏水传感器,根据底物的疏水性在“结合–解离”两种状态间切换:当底物为亲水性基质靶向的蛋白时,Mgr2紧密贴合Tim17,封闭侧向出口,促进基质侧转位;当底物为疏水性跨膜段时,Mgr2 迅速脱离Tim17,开放侧向通道,实现膜蛋白插入。这一发现颠覆了领域长期以来的假设,并建立了一种区别于经典 Sec 转位孔的新型转位模型:无需全局构象变化,而是通过局部动态调控实现精准分拣。
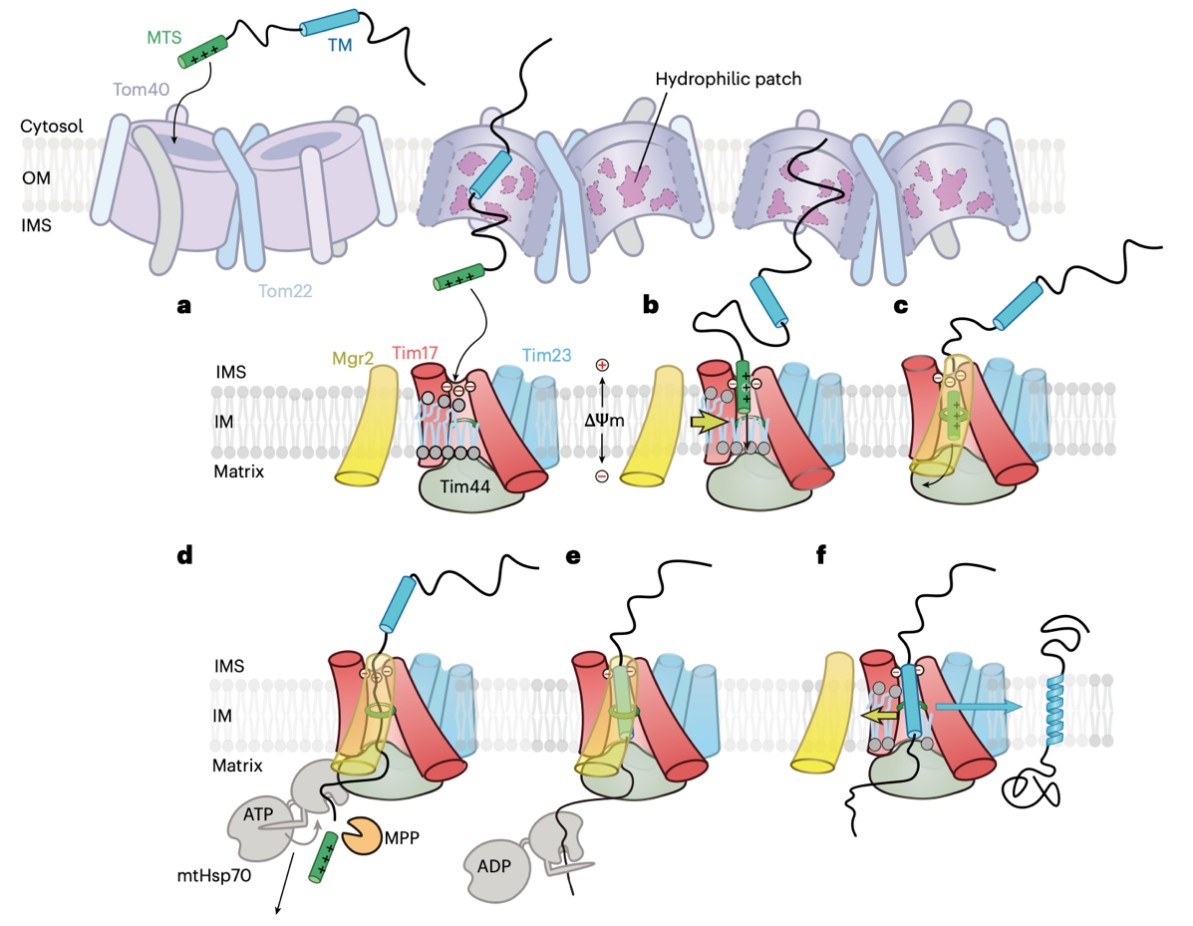
图1 线粒体蛋白通过TOM-TIM23超级复合体转位的模型
该研究不仅为理解线粒体蛋白跨膜转位提供了关键结构依据,也揭示了一种分子层面的“动态门控”机制,解释了线粒体如何高效处理数量庞大、性质各异的蛋白底物。这一机制可能在其他细胞器蛋白转位系统中亦具有启发意义。此外,TOM–TIM23 通路与多种线粒体相关疾病(如神经退行性疾病、代谢综合征)密切相关,研究成果为靶向线粒体蛋白转位的小分子药物设计提供了结构基础。
必赢bwin线路检测中心李龙研究员以及前沿交叉学科研究院定量生物学中心宋晨研究员为该论文通讯作者。必赢bwin线路检测中心2025届毕业生杨玉琪博士、2020级必赢bwin线路检测中心博士生王珊珊、必赢bwin线路检测中心冷冻电镜平台王国鹏博士和2021级必赢bwin线路检测中心博士生连宇珂是该论文的共同第一作者,宋晨实验室2021级博士生薛凌峰,郭强研究员和其实验室江文宏博士为该研究工作做出了重要贡献。生物物理所章新政老师为数据计算提供了宝贵建议。该研究工作得到必赢bwin线路检测中心冷冻电镜平台、高性能计算中心、必赢bwin线路检测中心仪器中心以及凤凰工程蛋白质平台的大力支持,获得膜生物学全国重点实验室、北大-清华生命科学联合中心、启东创新基金,科技部重点研发项目和国家自然科学基金项目的资助。